Pärmivaramu
Eesti loodusest kogutud pärmide kollektsioon
Kollektsioon sai alguse 2018. aastal kui kooliõpilasi kaasav teadusprojekt „101 pärmitüve Eesti loodusest“ andis tõuke pärmseente leviku uurimisele Eestis. Projekt toimus prof. Arnold Kristjuhani ja prof. Tiina Tamme poolt juhitud uurimisrühmade koostöös.
Aastate jooksul oleme kollektsiooni pidevalt täiendanud. Igal õppeaastal koguvad molekulaarsete bioteaduste õppekava magistrandid loodusest proove ja isoleerivad uusi pärmiliike aine „Pärmid – mudelorganismidest patogeenideni“ raames.
rohkem kui 3350 pärmitüve, mis on eraldatud 784 proovist;
167 erinevat pärmiliiki (neist 144 on määratud liigi tasemel ja 23 perekonna tasemel).
Pärmiliikide määramise metoodikast loe lisa Novaatori artiklist
Alates 2023. aastast kuulub kollektsioon ülemaailmsesse kultuurikollektsioonide liitu (World Data Centre for Microorganisms).
Looduslike pärmiproovide kogumisel osales 51 õpilast Eesti üldhariduskoolidest. September-oktoober 2018 toimunud aktiivse proovide korjamise perioodil isoleeriti 822 erinevat tüve. Projekti kohta saab lugeda lähemalt Novaatori artiklist.
Suur, suur tänu õpilastele ja õpetajatele, kes proovide kogumisest osa võtsid!
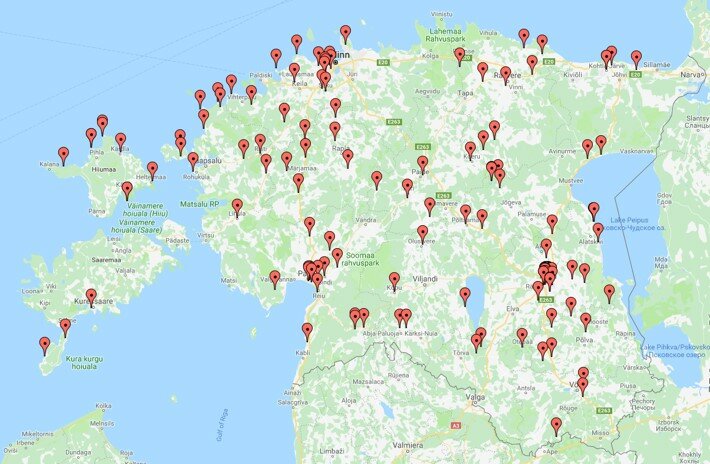
Projekti käigus võetud proovide kogumiskohad Eesti kaardil. Foto: erakogu
Proovide kogumisel osalesid järgmised koolid:
| Audentese Spordigümnaasium | Kääpa Kool | Sindi Gümnaasium |
| Häädemeeste Keskkool | Lihula Gümnaasium | Tallinna Lilleküla Gümnaasium |
| Jõgevamaa Gümnaasium | Nõva Kool | Tallinna Prantsuse Lütseum |
| Kadrina Keskkool | Paide Gümnaasium | Tallinna Reaalkool |
| Koeru Keskkool | Parksepa Keskkool | Tartu Kristjan Jaak Petersoni Gümnaasium |
| Kohila Gümnaasium | Pernova Hariduskeskus | Tartu Tamme Gümnaasium |
| Kohtla-Järve Täiskasvanute Gümnaasium | Põltsamaa Ühisgümnaasium | Tartu Täiskasvanute Gümnaasium |
| Kohtla-Järve Vene Gümnaasium | Pärnu Sütevaka Humanitaargümnaasium | Vinni-Pajusti Gümnaasium |
| Kunda Ühisgümnaasium | Pärnu Ühisgümnaasium | Vändra Gümnaasium |
| Rakvere Gümnaasium |
Pärme peetakse üheks esimeseks „kodustatud“ organismiks. Juba vanas Egiptuses oli kasutusel leiva küpsetamine. Arheoloogid on väljakaevamistel leidnud uhmerkive ja küpsetusahjusid, mis on rohkem kui 4000 aastat vanad. Samuti kujutatakse leiva tegemist Vana-Egiptuse joonistustel. Seega, kuigi me igapäevaselt ei mõtle pärmidele, elame me nendega koos juba väga kaua aega ning kasutame neid igapäevaselt.
Pärmid on ühe-rakulised organismid, keda palja silmaga ei näe. Nad kuuluvad Seeneriigi kahte hõimkonda: kottseened (Ascomycota) ja kandseened (Basidiomycota). Pärmid jagunevad pungumise või pooldumise teel. Erinevalt paljudest teistest seentest, pärmid sugulisel paljunemisel viljakeha ei moodusta.
Ajalugu ja tänapäev
Suurem osa ajaloost on peetud pärme elututeks. Alles mikroskoopide arenemisega oli võimalik neid organisme hakata nägema. 19. sajandi alguses kirjeldasid kolm kuulsat teadlast (Charles Cagniard-Latour, Friedrich Kützing ja Theodor Schwann) esmakordselt pärmide rakke ning nende jagunemist. Läbimurdeks aga osutus 19. sajandi teisel poolel toimunud Loius Pasteur’i avastus, et just pärmid on olulised kääritamise läbiviijad ning süsihappegaas, tänu millele tainas kerkima hakkab, on pärmide elutegevuse tulemus.
Pärmivaramu kollektsioonis leiduvad pärmiliigid. Foto: erakogu
Tänapäeval teatakse umbes 2000 erinevat pärmiliiki. Pärmid leiavad kasutamist nii toiduainetetööstuses (näiteks pagaritööstuses, ensüümide ja toidulisandite tootmises), kääritamisel (näiteks veini, õlu, kalja ja bioetanooli tootmisel), farmaatsiatööstuses (näiteks hormoonide ja ravimite tootmisel) ja teadusuuringutes (näiteks rakubioloogis, molekulaarbioloogias, ravimiuuringutes, toksilisuse uuringutes, pärilike haiguste uuringutes jne).
Kuidas pärmiliike määrata?
Pärmiliike ei ole võimalik eristada lihtsalt vaatluse teel. Liikide määramiseks tuleb analüüsida rakkudes olevat genoomset DNA-d ehk desoksüribonukleiinhapet. Liigi kindlaks tegemiseks tuleb pärmigenoomist paljundada kindel piirkond ning määrata saadud DNA fragmendi järjestus. Seejärel võrreldakse saadud järjestust andmebaasides olevate järjestustega. Uus liik leitakse, kui uuritav ala erineb varem kindlaks tehtud järjestustest.

Pildil on liikide määramine molekulaarbioloogia meetoditega. Foto: erakogu

2024. aastal alguse saanud Euroopa Liidu ja Haridus- ja Teadusministeeriumi poolt rahastatud TemTA projekti eesmärk on selgitada välja kas Eesti loodusest kogutud pärmseeni on võimalik kasutada taimehaiguste biotõrjes. Projekt toimub Maaelu Teadmusikeskuse ja MRI uurimsirühmade koostöös ning kestab kuni 2028 aasta lõpuni.
Ava Maaelu Teadmuskeskuse koduleht
Pärmivaramu liikide analüüsimisel leitakse kohalikud pärmid, mida saab rakendada taimehaiguste bioloogilises tõrjes. Nende pärmide kasutamine võimaldab kombineerida keemilist ja bioloogilist tõrjet, mis teeb taimehaiguste tõrje efektiivsemaks. Kombineeritud tõrje tulemusena väheneb sünteetiliste fungitsiidide kasutamine ning välditakse resistentsuse teket ning levikut patogeenide populatsioonis.
Pildil: Tartu Ülikooli molekulaarbioloogia professor Tiina Tamm talinisult proove võtmas. Foto: erakogu
Uuringu eesmärgiks oli iseloomustada õunaviljade pinnal kasvavaid kultiveeritavaid pärmseeni. Proovide kogumine toimus aastate 2018 ja 2020–2022 sügisperioodil.
- Pärmide isoleerimiseks koguti õunu 37 Eesti eri paigust. Kolm enim analüüsitud õunasorti olid „Liivi Kuldrenett“, „Antonovka“ ja „Talvenauding“.
- Õuntelt eraldati 230 pärmi isolaati, mida säilitatakse puhaskultuuridena Eesti Pärmivaramu kollektsioonis.
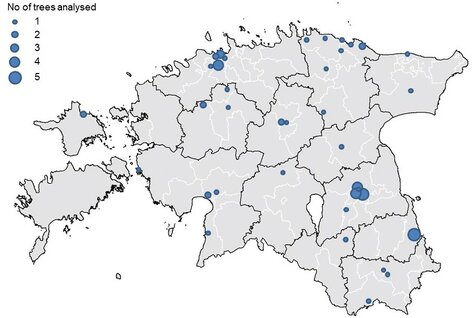
Proovide korjamise asukohad Eesti kaardil. Näidatud on igast kohast analüüsitud puude arv. Allikas: Heliyon
Isolaatide liigilise kuuluvuse määramiseks analüüsiti genoomi kolme eri piirkonda: ribosomaalse RNA geeni 5,8S-ITS piirkonda, ribosoomi suure subühiku RNA piirkonda D1/D2 ning mõnede pärmide puhul ka translatsiooni elongatsioonifaktori 1α (TEF1) geeni järjestust. Analüüsitud isolaadid kuulusid 33 eri liiki.
Seitsme isoleeritud liigi puhul erinesid isolaadid märkimisväärselt nende lähimatest sugulastest ja võivad seetõttu esindada uusi, eraldi liike. Uuringu põhjal saab väita, et õunaviljadega seotud looduslik pärmseente kooslus parasvöötme põhjaosas on mitmekesine.
Uuringu tulemustest loe lähemalt ajakirjas Heliyon avaldatud teadusartiklist.
Desoksüribonukleiinhape ehk DNA on pärilikku informatsiooni säilitav aine ning seda leidub igas elavas rakus. Tänapäeval kasutatakse DNA analüüsimist paljudes eluvaldkondades. Selleks tuleb DNA rakkudest puhastada ning huvipakkuvad DNA järjestused polümeraasi ahelreaktsiooni (PCR) meetodi abil paljundada.
DNA isoleerimiseks kasutatakse mitmed erinevad meetodid, milledest mõned on keerulised ning vajavad spetsiaalset laboritehnikat. Meie oleme välja töötanud meetodi, et eraldada erinevatest pärmiliikidest genoomne DNA kiirelt (tehtav 1 tunniga), lihtsalt ja kuluefektiivselt. Puhastatud DNA-d saab kasutada seejärel PCR-põhistes rakendustes.

Pärmirakkudest genoomse DNA eraldamise meetod visualiseeritult. Allikas: STAR Protocols
See meetod on sobilik juhul kui on vaja analüüsida samaaegselt palju proove korraga. Laboriseadmetest läheb vaja vaid kuumutusblokki ja tavalist lauatsentrifuugi. Kogu protseduur toimub ühes tuubis, ei kasutata ensüüme ega kahjulikke kemikaale ning vajalikke lahuseid saab säilitada ruumitemperatuuril.
Kasutasime seda meetodit erinevatest looduslikest elupaikadest isoleeritud pärmseente molekulaarseks identifitseerimiseks. See meetod on sobilik ka laboris kasutatavate pärmseente genotüpiseerimiseks.
Meetodist saab lähemalt lugeda ajakirjas STAR Protocols avaldatud teadusartiklist.



